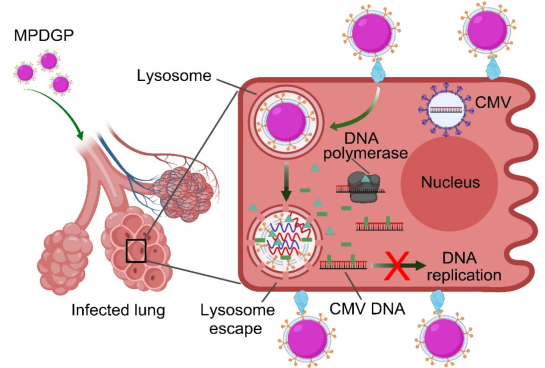
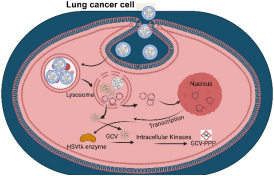
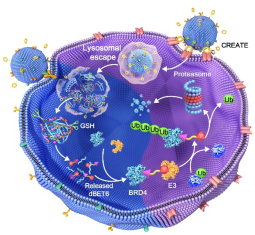
外泌体是内涵体来源,经由多泡体与质膜融合以后释放到细胞外的,直径介于50-150 nm之间的膜性囊泡状小体。外泌体是细胞间物质和信号通讯的重要载体,这启发人们将其开发成新型药物递送载体。然而,天然外泌体分离方法步骤繁多、分离效率低、组分不纯。更关键的问题在于,外泌体的内容物及表面蛋白与细胞的种属、分化程度、状态等各种条件紧密相关。受这些条件的限制,人们很难重复性地获得大量结构属性一致外泌体,这就严重限制了它的研究应用。余细勇-张灵敏课题组针对以上阻碍天然外泌体用于药物递送的难题,采用仿生化策略,开发出新型人工外泌体,用于递送核酸和小分子化合物等药物,实现疾病的靶向精准治疗。在前期研究基础上(Chem. Engin. J., 2021, 19, 131926; J Nanobiotechnol., 2021, 19, 364; J. Colloid Interface Sci., 2021, 603, 319-332; Pharmacol. Res., 2021, 171, 105787),余教授等利用不同细胞来源的细胞膜,制备人工外泌体并负载核酸或小分子化合物药物,用于炎症和肿瘤的治疗。结果表明,人工外泌体具有高载药能力、高靶向性以及良好的生物相容性,并可在靶细胞内智能释放药物,实现高效的炎症和肿瘤治疗。这些研究进展有望为治疗炎症以及肿瘤相关疾病提供新的治疗方式和思路。相关研究成果于近期发表3篇研究论文,包括J. Nanobiotechnol. (IF=9.42),J. Colloid Interface Sci. (IF=9.96)和Adv. Sci. (IF=17.52)。上述研究工作以广州医科大学药学院为通讯作者单位,获得了国家自然科学基金、广东省自然科学基金和广东省教育厅项目的资助。
J. Nanobiotechnol. 2022, 20, 335. (DOI: 10.1186/s12951-022-01547-x)

撰稿人:张灵敏