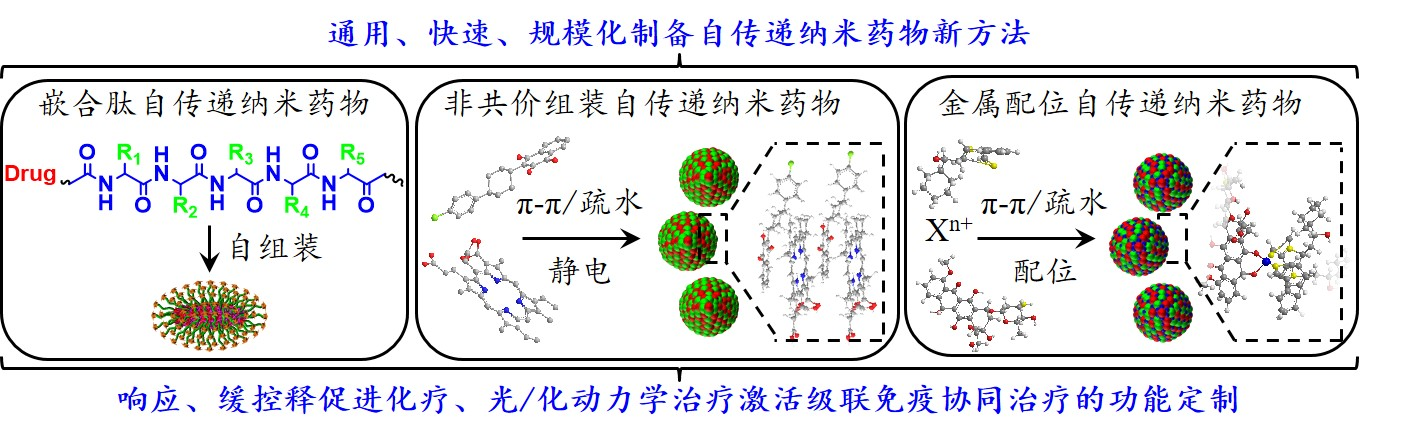
纳米药物研发面临载体合成复杂、药物装载量少、载体安全隐患等问题,亟需构筑通用、快速、规模化的纳米药物制备方法和抗肿瘤创新协同机制。基于抗肿瘤生物医用材料的研究基础(ACS Nano 2017, 11, 7006-7018;Adv. Funct. Mater. 2017, 27, 1604916;Biomaterials 2017, 142, 149-161; 2016, 104, 297-309; 2018, 1, 1-12; 2019, 195, 75-85; Adv. Funct. Mater. 2015, 25, 7317-7326; Adv. Sci. 2021, 2004555),本课题组构建了嵌合肽功能化自传递纳米药物,形成了多细胞器靶向递送新方法(Biomaterials 2019, 188, 1-11,2019, 211, 14-24,2019, 224, 119497;Appl. Mater. Today. 2019, 16, 120-131;Adv. Health. Mater. 2021, 202100198);发展了基于非共价组装的二元、三元自传递纳米药物,形成了载药量接近100 %、生理环境稳定和无载体药物递送新策略(Nano Lett. 2020, 20, 2062-2071;ACS Nano 2020, 14, 17100-17113;Small 2021, 2102470;J. Colloid. Interf. Sci. 2021, 612, 562-571; 2022, 622, 298-308;Adv. Health. Mater. 2022, e2202307);发展了基于金属离子与含苯酚、咪唑、蒽醌、吡啶等亚结构配位作用的金属配位纳米药物组装体,实现了纳米药物快速、通用和规模化制备(J. Control. Release 2021, 336, 159-168; Biomaterials 2021, 275, 120970; 2022, 286, 121576; Chem. Eng. J. 2023, 453, 139729);拓展了自传递纳米药物光、氧化还原、酸、酶等刺激响应特性,实现了药物靶向递送、缓控释促进抗肿瘤化疗、光/化动力学治疗激活级联免疫协同治疗的功能定制(ACS Nano 2022, 16, 1182-1197; Chem. Eng. J. 2022, 435, 134783; 2023, 453, 139729; Adv. Health. Mater. 2022, 202102038; Small 2022, 2205694)。上述研究工作得到了国家重点研发计划、国家自然科学基金、中国科学技术协会、广东省自然科学基金、广东省分子靶标与临床药理重点实验室、广州医科大学高水平大学建设、呼吸疾病国家重点实验室等项目资助。
撰稿人:李仕颖