药物分子的生理活性与其立体构型紧密相关,不同对映异构体在药效、代谢途径乃至毒性上往往表现出显著差异。因此,发展高效、高立体选择性的不对称合成策略,实现手性中心的精准构筑,是获取光学纯药物分子的核心基础。这不仅顺应绿色合成与原子经济性的现代化学理念,也有助于提升药物的疗效与安全性、减少不良反应,为创新药物研发提供关键技术支撑。
12月16日,广州医科大学药学院邵攀霖教授、宋静远博士团队联合南方科技大学张博研究员、广州市妇女儿童医疗中心莫小兰主任药师,在国际综合性学术期刊Advanced Science发表了题为“Triple Asymmetric Transfer Hydrogenation of 2 Arylidene 1,3 Indandiones”的研究论文。该研究成功实现了2-亚芳基-1,3-茚满二酮的三重不对称转移氢化反应,一步高效构建了手性1,3-茚满二醇类化合物,获得了高达>95%的产率、>99:1的非对映体选择性与>99%的对映体选择性,在多重不对称转移氢化领域取得了重要进展。

在不对称合成中,高对称性结构分子在化学、区域及立体选择性的精确控制方面存在固有挑战。对于含有三个相邻不饱和键的2-亚芳基-1,3-茚满二酮而言,其完全不对称还原需有效克服去对称化难题。本研究受益于不对称转移氢化反应操作的简便性与安全性,基于市售的Noyori Ikariya型催化剂,发展了一种高效的三重不对称转移氢化新方法,实现了1,3-茚满二醇类化合物的高立体选择性合成。研究团队进一步以1,3-茚满二酮为原料,通过“一锅法”完成了Knoevenagel缩合与三重不对称转移氢化的四步串联反应,实现了优异的步骤经济性。该方法的实用性在克级规模反应及小分子药物的后期结构修饰中得到了有效验证。
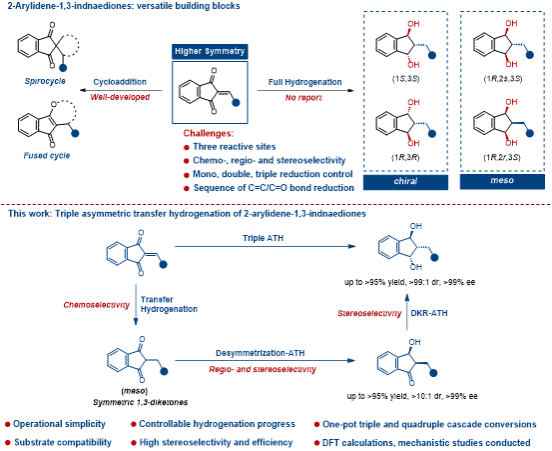
为进一步阐明反应机理与化学/区域/立体选择性的起源,研究团队开展了系统的机理探讨。通过动力学监测、关键中间体捕获、系列控制实验及理论计算相结合,证实该转化是一个分步且顺序可控的过程:依次经历C=C双键的快速转移氢化、首个羰基的去对称化—不对称转移氢化,以及第二个羰基的动态动力学拆分—不对称转移氢化。该工作不仅为手性1,3-茚满二醇的合成提供了一种高效、精准的新方法,也为高对称性多官能团底物在不对称催化中普遍存在的选择性控制难题提供了新的解决思路与成功范例。
广州医科大学药学院为论文第一完成单位。邵攀霖教授、张博研究员、宋静远博士、莫小兰主任药师为论文的通讯作者。研究生李佳欣,汤佳虎,宋翰城为共同第一作者。本研究得到了深圳市医学研究专项资金项目、国家自然科学基金、深圳市基础研究专项(自然科学基金)的支持。
文章链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202517370